ESTRUCTURA DE LOS MATERIALES, PROPIEDADES Y ENSAYOS DE MEDIDA
- ESTRUCTURA ELECTRONICA
Los átomos están formados por:
-Electrones: Tienen carga positiva y giran alrededor del núcleo.
-Protones: Tienen carga negativa.
-Neutrones: Forman el núcleo junto a los protones.
Configuración electrónica: indica de que manera se estructuran los átomos.(wikipedia)
Elementos electropositivos: son metálicos por naturaleza y ceden electrones para crear iones positivos.
Elementos electronegativos: son no metálicos y aceptan electrones para crear iones negativos.
Los elementos mas electropositivos se encuentran en la parte izquierda de la tabla periódica, siendo los mas electropositivos Cesio(Cs), Francio(Fr) y Radio(Ra).
- ENLACES ENTRE ÁTOMOS
Un enlace atómico es un enlace químico, un proceso responsable de las interacciones átomos y moléculas.
-Covalentes: los átomos comparten electrones para ser mas estables.(H+Cl)
-Iónico: se produce entre elementos metálica y no metálicos en el que los metálicos ceden electrones a los no metálicos.(Na+Cl)
-Metálico: Los átomos de los metales tienen pocos electrones en su última capa. Estos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos.
- ESTRUCTURA CRISTALINA
La estructura cristalina es la forma solida de como se ordenan los átomos, moléculas o iones. Estos son empaquetados de manera ordenada y con patrones de ordenación que se extienden en las tres dimensiones del espacio.
- PROPIEDADES MECÁNICAS DE LOS MATERIALES
-Plasticidad: Capacidad de un material para conservar su forma una vez deformado.
-Cohesión: Resistencia de los átomos a separarse unos de otros.
-Dureza: Oposición que ofrece un cuerpo a rayarse.
-Tenacidad: Resistencia que ofrece un cuerpo que esta sometido a procesos lentos de deformación.
-Resiliencia: Resistencia que opone un cuerpo a los choques o esfuerzos bruscos.
-Fragilidad: Es lo opuesto a la resiliencia.
-Resistencia a la fatiga: Propiedad que presentan los materiales aponerse a diversas fuerzas.
- DIFERENCIA ENTRE MATERIALES PLÁSTICOS, ELÁSTICOS Y FRÁGILES
Materiales plásticos: se ablandan a determinada temperatura. Según su comportamiento al variar la temperatura pueden ser: -Termoplásticos: Se ablandan cuando se calientan y pueden moldearse y darle nueva forma al enfriarse. -Termoestable: al someterlos a calor y moldearlos adquieren una forma que conservan cuando se enfrían. -Elastómeros: Tienen gran elasticidad, adherencia y dureza.
Materiales elásticos: Los materiales elásticos son aquellos materiales que tienen la habilidad de resistir a una influencia o fuerza distorsionadora o deformadora, para luego retornar a su forma y tamaño original cuando la misma fuerza es retirada.
Materiales frágiles: Se fracturan con escasa deformación.
- ENSAYO DE TRACCIÓN
El ensayo de tracción se un materia consiste en someter a una probeta a un esfuerzo de tracción creciente hasta que se produzca la rotura de la misma. Este ensayo mide la resistencia de un materia a una fuerza estática o aplicada lentamente.
Cuando sobre un cuerpo actúa una fuerza pequeña que trata de deformarlo se produce una deformación elástica, que se recupera al desaparecer esa fuerza. Pero superado un cierto valor, la deformación que sufre el cilindro es permanente, o plástica.
La respuesta de un material ante la deformación está influenciada por la relación entre la fuerza aplicada y el tamaño del objeto. Por lo tanto, no se analiza la fuerza sino ésta dividida entre el área que debe soportarla. A este valor se le denomina esfuerzo, y la unidad del Sistema Internacional es el N/m² o Pa (pascal),
- ENSAYO BRINELL:
Es el que se emplea para determinar la dureza de un material mediante la penetración en él de una esfera o bola de acero templado de determinado diámetro en la superficie que se ensaya, bajo una carga dada y durante determinado intervalo de tiempo. La dureza Brinell se calcula en función del área del casquete de la huella realizada y de la carga aplicada. En este ensayo la carga a aplicar depende del material a ensayar y del cuadrado del diámetro de la bola del penetrador.
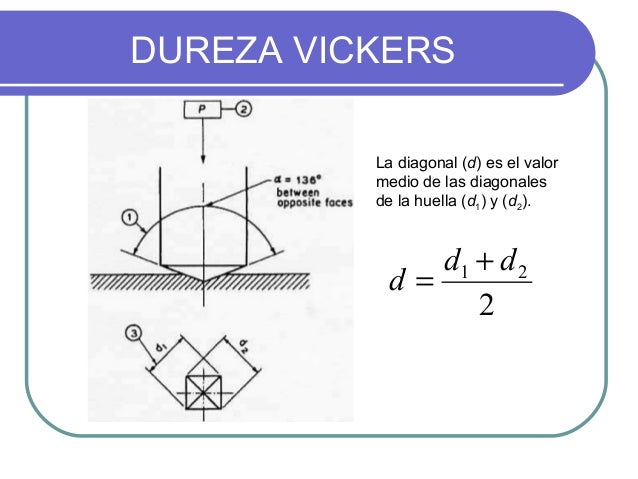
- ENSAYO VICKERS:
Es el que se emplea para determinar la dureza de un material mediante la penetración en él de un diamante de forma piramidal. Se emplea fundamentalmente en los ensayos de materiales de gran dureza y de la piezas con secciones muy pequeñas, o en capas muy finas exteriores como son: las nitruradas, cementadas, etc. La dureza Vickers se calcula de forma similar a como lo hacíamos en el ensayo Brinell. En este caso la dureza es función de la superficie lateral de la huella y de la carga aplicada. El ensayo Vickers tiene una serie de ventajas sobre el Brinell:
Se puede emplear con piezas de espesores muy reducidos (hasta 0.2 mm).
Puede medir dureza superficial aunque la huella sea poco profunda.
Se puede utilizar en superficies cilíndricas o esféricas.
Se puede utilizar indistintamente con materiales muy duros, o con materiales blandos.
- ENSAYO ROCKWELL:
El ensayo Rockwell es un ensayo rápido y fácil de realizar pero menos preciso que los anteriores, en el que la dureza se obtiene en función de la profundidad de la huella y no de la superficie como en el Brinell y el Vickers. Para realizar este ensayo se siguen los siguientes pasos:
- Se aplica una carga de 10 kg al penetrador (bola o cono), provocando una pequeña huella en la superficie del material a ensayar; se mide la profundidad de esta huella, h1, y se toma como referencia, colocando a cero el comparador de la máquina.
- Se aumenta en 90 kg la carga, si se emplea el penetrador de bola y en 140 kg si es el de cono, manteniendo la carga durante un tiempo entre 1 y 6 segundos; a continuación se mide la profundidad de la huella producida, h2.
- Se retira la carga, con lo que el material trata de recuperar su posición inicial quedando una huella permanente de una profundidad h1+e.
- ENSAYO DE FATIGA:
Se define que un material trabaja a fatiga cuando soporta cargas que varían cíclicamente con el tiempo.
Comportamiento de los materiales a la fatiga:
| A- |
| ||||||||
| B- |
| ||||||||
| C- |
|
ENSAYOS TECNOLÓGICOS:
Los ensayos tecnológicos se utilizan para comprobar si un material es útil para una aplicación cuando no ha sido posible realizar comprobaciones tras los ensayos realizados.
Permiten solamente determinar si el material es útil o inútil para un propósito. Se empezaron a utilizar desde el momento en el que se comenzó la obtención y transformación de materiales. Se pretende representar las condiciones que va a sufrir el material, y depende de la forma geométrica del mismo.
Tipos de ensayos:
A- Ensayos en barras
- Ensayo de flexión y plegado
- Ensayo de recalcado
- Ensayo de maleabilidad
- Ensayo de mandrilado
B- Ensayo en chapas
- ensayo de embutición
C- Ensayos en tubos
- Ensayo de ensanchamiento
- Ensayo de aplastamiento
- Ensayo de estanqueidad
- Ensayo de recanteado
D- Ensayos en alambres
- OXIDACIÓN Y REDUCCIÓN:
Se denomina reacción de reducción-oxidación, o reacción redox, a toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
El término OXIDACIÓN comenzó a usarse para indicar que un compuesto incrementaba
la proporción de átomos de Oxígeno.
Igualmente, se utilizó el termino de REDUCCIÓN para indicar una disminución en la
proporción de oxígeno.
Actualmente, ambos conceptos no van ligados a la mayor o menor presencia de
Oxígeno. Se utilizan las siguientes definiciones:
- OXIDACIÓN: Pérdida de electrones (o aumento en el número de oxidación).
- REDUCCIÓN: Ganancia de electrones (o disminución en el número de oxidación).
Siempre que se produce una oxidación debe producirse simultáneamente una reducción.
Cada una de estas reacciones se denomina semirreacción.
Cuando un elemento químico reductor cede electrones al medio, se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un «par redox». Análogamente, se dice que, cuando un elemento químico capta electrones del medio, este se convierte en un elemento reducido, e igualmente forma un par redox con su precursor oxidado. Cuando una especie puede oxidarse, y a la vez reducirse, se le denomina anfolito, y al proceso de la oxidación-reducción de esta especie se le llama anfolización
- CELDA ELECTROQUÍMICA:
Una celda electroquímica es un dispositivo capaz de obtener energía eléctrica a partir de reacciones químicas (o bien, de producir reacciones químicas a través de la introducción de energía eléctrica, cuando se esté cargando la celda).
Hay dos tipos fundamentales de celdas y en ambas tiene lugar una reacción redox, y la conversión o transformación de un tipo de energía en otra:
- La celda galvánica o celda voltaica transforma una reacción química espontánea en una corriente eléctrica, como las pilas y baterías. Son muy empleadas.
- La celda electrolítica transforma una corriente eléctrica en una reacción química de oxidaciónreducción que no tiene lugar de modo espontáneo. En muchas de estas reacciones se descompone una sustancia química por lo que dicho proceso recibe el nombre de electrolisis.
- TIPOS DE CORROSIÓN
- General o Uniforme
Es aquella corrosión que se produce con el adelgazamiento uniforme producto de la pérdida regular del metal superficial. A su vez, esta clase de corrosión se subdivide en otras:
- Atmosférica
De todas las formas de corrosión, la Atmosférica es la que produce mayor cantidad de daños en el material y en mayor proporción. Grandes cantidades de metal de automóviles, puentes o edificios están expuestas a la atmósfera y por lo mismo se ven atacados por oxígeno y agua. La severidad de esta clase de corrosión se incrementa cuando la sal, los compuestos de sulfuro y otros contaminantes atmosféricos están presentes.
- Galvánica
La corrosión Galvánica es una de las más comunes que se pueden encontrar. Es una forma de corrosión acelerada que puede ocurrir cuando metales distintos (con distinto par redox) se unen eléctricamente en presencia de un electrolito (por ejemplo, una solución conductiva).
2-Metales Líquidos
La corrosión con metales líquidos corresponde a una degradación de los metales en presencia de ciertos metales líquidos como el Zinc, Mercurio, Cadmio, etc. Ejemplos del ataque por metal líquido incluyen a las Disoluciones Químicas, Aleaciones Metal-a-Metal (por ej., el amalgamamiento) y otras formas.
3-Altas Temperaturas
Algunos metales expuestos a gases oxidantes en condiciones de muy altas temperaturas, pueden reaccionar directamente con ellos sin la necesaria presencia de un electrolito. Este tipo de corrosión es conocida como Empañamiento, Escamamiento o Corrosión por Altas Temperaturas.
Generalmente esta clase de corrosión depende directamente de la temperatura.
4-Corrosión por Fisuras o “Crevice”
La corrosión por crevice o por fisuras es la que se produce en pequeñas cavidades o huecos formados por el contacto entre una pieza de metal igual o diferente a la primera, o más comúnmente con un elemento no- metálico. En las fisuras de ambos metales, que también pueden ser espacios en la forma del objeto, se deposita la solución que facilita la corrosión de la pieza. Se dice, en estos casos, que es una corrosión con ánodo estancado, ya que esa solución, a menos que sea removida, nunca podrá salir de la fisura. Además, esta cavidad se puede generar de forma natural producto de la interacción iónica entre las partes que constituyen la pieza.
5- Corrosión por picadura
Es altamente localizada, se produce en zonas de baja corrosión generalizada y el proceso (reacción) anódico produce unas pequeñas “picaduras” en el cuerpo que afectan. Puede observarse generalmente en superficies con poca o casi nula corrosión generalizada.
- PROTECCION CONTRA LA CORROSIÓN
- Recubrimientos: Estos son usados para aislar las regiones anódicas y catódicas e impiden la difusión del oxígeno o del vapor de agua, los cuales son una gran fuente que inicia la corrosión o la oxidación.
- Elección del material: La primera idea es escoger todo un material que no se corroa en el ambiente considerado. Se pueden utilizar aceros inoxidables, aluminios, cerámicas, polímeros (plásticos), FRP, etc. La elección también debe tomar en cuenta las restricciones de la aplicación (masa de la pieza, resistencia a la deformación, al calor, capacidad de conducir la electricidad, etc.).Cabe recordar que no existen materiales absolutamente inoxidables; hasta el aluminio se puede corroer. En la concepción, hay que evitar las zonas de confinamiento, los contactos entre materiales diferentes y las heterogeneidades en general. Hay que prever también la importancia de la corrosión y el tiempo en el que habrá que cambiar la pieza (mantenimiento preventivo).
- Diseño: El diseño de las estructuras del metal, estas pueden retrasar la velocidad de la corrosión.
- Protección de Barrera: Pinturas (Liquida o en polvo),Deposito electrolítico (cincado, cromado, estañado etc.)Y Metalizados.
- BIBLIOGRAFÍA
https://www.upv.es/materiales/Fcm/Fcm02/ptrb2_2_4.html
https://es.m.wikipedia.org/wiki/Ensayos_tecnológicos
https://www.textoscientificos.com/quimica/corrosion/tipos
http://medidasdedefensacontralacorrosion.blogspot.com.es/2012/06/medidas-de-proteccion-contra-la.html
http://e-ducativa.catedu.es/44700165/aula/archivos/repositorio/4750/4913/html/141_ensayo_brinell.html
http://fresno.pntic.mec.es/~fgutie6/quimica2/ArchivosPDF/05Redox.pdf
https://es.m.wikipedia.org/wiki/Celda_electroqu%C3%ADmica
https://es.wikipedia.org/wiki/%C3%81tomo
https://jorgegchua.wordpress.com/2014/06/17/materiales-plasticos-elasticos-y-fragiles/
https://tecnologia-materiales.wikispaces.com/Propiedades+Mecanicas?responseToken=0a840cb4dedda262ea2937436c092815f







Comentarios
Publicar un comentario